Forschung
Mechanoelektrische Transduktion in Haarzellen
Elektromechanische Transduktion in äußeren Haarzellen
Mechanoelektrische Transduktion in Haarzellen
Schallinduzierte Schwingungen der cochleären Flüssigkeiten werden durch mechanosensitive Ionenkanäle in den Stereozilien (Härchen) in einen elektrischen Strom umgewandelt. Diese Kanäle werden durch die Auslenkung der Stereozilien geöffnet und geschlossen. Der Öffnungsmechanismus der Kanäle ist noch immer unbekannt. Der Mechanismus ist rein mechanisch. Er muss rein mechanisch sein, da er sonst die extremen Geschwindigkeitsanforderungen nicht erfüllen könnte: 200 kHz bei einigen Fledermausspezies und immerhin noch moderate 20 kHz beim Menschen. Das Öffnen und Schließen der Kanäle ist mit sehr feinen extrazellulären Filamenten assoziiert, so genannten Tip-Links, deren Durchmesser ca. 6 nm beträgt. Zerstörung der Tip-Links, z.B. durch Schalltrauma, führt zur Schwerhörigkeit.
Wir untersuchen mechanoelektrische Transduktionsprozesse, mit Hilfe der Ganzzell-Patch-Clamp-Technik in Kombination mit der Fluoreszenzdarstellung der Kalziumaufnahme mittels der Zwei-Photonen Laser-Scanning Konfokalmikroskopie. Wir konnten zeigen, dass enzymatische und nicht enzymatische Zerstörung der Tip-Links die Kanäle öffnet und einen tonischen Strom induziert (Meyer et al., 1998). Wir konnten zeigen, dass dieser tonische Strom mechanosensitiv ist und sein Öffnungsmechanismus kalziumabhängig ist (Meyer et al., 2005). Diese Daten sind ein Hinweis auf ein intrazelluläres, kalziumabhängiges elastisches Öffnungselement. Gegenwärtige Experimente beschäftigen sich mit der Lokalisation der mechanosensitiven Kanäle und Kalziumdynamik in den Stereozilien.
Elektromechanische Transduktion in äußeren Haarzellen
Eine Änderung des Membranpotentials der äußeren Haarzellen (ÄHZ) wird in eine mechanischen Kraft umgewandelt, die den Zellkörper abwechselnd dehnt und staucht. Diese elektrisch induzierte Bewegung, die so genannte somatische Elektromotilität, wird von den meisten Forschern für die Grundlage der außerordentlich hohe Frequenzselektivität, der Empfindlichkeit und des Dynamikbereichs der Cochlea gehalten. Man nimmt an, dass die von den Zellen produzierte elektromechanische Kraft den Dämpfungskräften in der Cochlea, wie sie z.B. in bewegten Flüssigkeiten und Zellen auftreten, entgegenwirkt und dadurch die hohe Frequenzabstimmung ermöglicht. Das Motor-Molekül, welches die somatische Elektromotilität antreibt, wurde von dem Team um Peter Dallos kloniert. Es gehört zu einer Genfamilie, der „solute carrier family 26“, die Anionen-Transporter und verwandte Proteine kodiert: es wird Prestin genannt. Es gibt mindestens 6.000 dieser Moleküle pro Quadratmikrometer Zellwandoberfläche. Nicht bekannt ist, wie die Bewegung dieser Moleküle an das Zytoskelett gekoppelt wird, um die somatische Elektromotilität hervorzurufen. Ebenso wie die mechanoelektrische Transduktion in den Stereozilien muss der Vorgang jedoch äußerst schnell sein, da er auch bei Ultraschall-Frequenzen noch funktioniert. Die Zerstörung der elektromechanischen Transduktion führt zur Ertaubung.
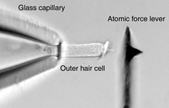
Wir untersuchen die elektromechanische Transduktion mithilfe einer Kombination aus Laser-Doppler-Vibrometrie und atomischer Kraft-Spektroskopie. Mit dem Vibrometer zeigten wir, dass die somatische Elektromotilität den Änderungen des Membranpotentials zyklusgetreu bis mindestens 100 kHz folgen kann (Frank et al., 1999). Dadurch stellten wir klar, dass der Zellkörper der ÄHZ die notwendige molekulare Maschinerie aufweist, um elektromechanische Antworten - ohne nennenswerte Abschwächung oder zeitliche Verzögerung - bis weit über den Frequenzbereich des Hörens zu erzeugen. In der Folge haben wir eine innovative Methode entwickelt, um die mechanischen Eigenschaften von biologischen Strukturen bis mindestens 40 kHz zu messen (Scherer et al., 2000; Scherer und Gummer, 2004a). Diese Technik benutzt einen Atom-Kraft-Balken als Sensor und ist auch für Anwendungen außerhalb der Hörforschung, insbesondere auch zur Untersuchung von biologischen Strukturen in Flüssigkeit, geeignet.
Wir verwenden diese Technik, um mechanische und zellbiologische Eigenschaften von zellulären und membranösen Strukturen in der Cochlea zu untersuchen. In Zusammenarbeit mit den Forschungsgruppen von Marlies Knipper und Dominik Oliver wurde kürzlich gezeigt, dass die von der äußeren Haarzelle (ÄHZ) aufgebrachte, somatische elektromechanische Kraft durch Interaktion zwischen Prestin und einer kalzium/kalmodulin-abhängigen Serin-Protein-Kinase (CASK) im basolateralen Bereich der Zelle moduliert werden könnte, und zwar in dem Grenzbereich zwischen prestin-exprimierender ÄHZ-Membran und prestin-freier ÄHZ-Membran (Cimerman et al., 2013).
Die erforderliche hohe Empfindlichkeit, Frequenzselektivität und Dynamikbereich der Cochlea können nur durch einen mechanischen Verstärkungsmechanismus erreicht werden. Es gibt zwei Vorstellungen darüber, wie diese Verstärkung erreicht werden könnte. Beide Hypothesen gehen davon aus, dass von einem elektromechanischen Wandler in den äußeren Haarzellen mechanische Kraft erzeugt wird: die eine behauptet, dass sich der Wandler im Zellkörper befinde und die andere, dass er in den Stereozilien sitze. Die Zellkörper-Hypothese hat den Vorteil, dass die äußeren Haarzellen bekanntermaßen über den gesamten funktional relevanten Frequenzbereich elektromotil sind (Frank et al., 1999), aber den Nachteil, dass das Rezeptorpotential (die treibende Kraft für die somatische Elektromotilität) durch die elektrische Impedanz der basolateralen Zellmembran tiefpassgefiltert ist (Preyer et al., 1996). Tiefpassfilterung relativ zur Auslenkung der Stereozilien dämpft und verzögert das Rezeptorpotential derart, dass die somatische Elektromotilität allein nicht für die cochleäre Verstärkung verantwortlich sein kann. Die Hypothese, dass der ausschlaggebende elektromechanische Wandler in den Stereozilien sitzt, hat den Vorteil, dass er nicht unter einer Tiefpass-Filterung durch die Stereozilienmembran leidet. Allerdings hat sie den Nachteil, dass es bis jetzt noch keinen direkten experimentellen Beweis dafür gibt, dass Stereozilien bei hohen Frequenzen elektromotil sind. Immerhin gibt es aus der Gruppe von Robert Fettiplace Hinweise dafür, dass es in den Stereozilien äußerer Haarzellen elektromechanische Wandler gibt. Ob diese jedoch bis zu den erforderlichen hohen Frequenzen arbeiten und genügend mechanische Kraft in das Corti'sche Organ einkoppeln können, muss erst noch gezeigt werden.
Wir untersuchen die Mechanismen der auf den äußeren Haarzellen basierenden cochleären Verstärkung. Auf der Grundlage von dreidimensionalen Schwingungsmessungen berichteten wir, dass die Tektorialmembran eine resonante Bewegung in der radialen Richtung ausführt (Gummer et al., 1996; Hemmert et al., 2000a). Wir schlugen vor, dass die zeitlichen Eigenschaften dieser Bewegung die durch die elektrische Impedanz der basolateralen Membran der äußeren Haarzellen verursachte Verzögerung der somatischen elektromechanischen Kraft kompensieren könnte. Diese Experimente gaben den ersten Hinweis darauf, wie die elektromechanische Kraft in das Corti’sche Organ auf eine Weise eingekoppelt werden könnte, die zur cochleären Verstärkung führt. Da Reibung und Trägheit des Corti’schen Organs bei hohen Frequenzen ebenfalls eine starke Dämpfung und Verzögerung der elektromechanischen Kraft verursachen könnte, haben wir auch die mechanische Impedanz des Corti’schen Organs gemessen (Scherer und Gummer, 2004a). Wir fanden, dass sich das Corti’sche Organ für eine punktförmige Last und bei allen physiologisch relevanten Frequenzen wie ein rein viskoelastisches Material verhält, d.h. es gab keine Inertialkomponente. Durch die Kombination dieser Impedanzmessungen mit Geschwindigkeitsmessungen auf dem durch intracochleäre elektrische Stimulation angeregten Corti’schen Organ konnten wir zeigen, dass die elektromechanische Kraft auf die Retikularmembran ein breites Resonanzmaximum aufweist (Scherer und Gummer, 2004b). Wir stellen die Hypothese auf, dass eine piezoelektrische Resonanz der äußeren Haarzellen, wie sie von Bill Brownell und Mitarbeitern vorgeschlagen wurde, für diese resonante Kraft verantwortlich sein könnte. Diese Resonanz könnte die Amplitudendämpfung durch die elektrische Impedanz der basolateralen Zellmembran der äußeren Haarzelle kompensieren.
Zur Zeit untersuchen wir, wie die elektromechanische Kraft auf die Stereozilien der inneren Haarzellen (IHZ) gekoppelt wird. Bis jetzt haben wir den ersten Hinweis für einen neuen Stimulusmechanismus für die Auslenkung der IHZ-Stereozilien in Antwort auf die somatische elektromechanische Kraft der ÄHZ erbracht: In jeder cochleären Windung für Stimulusfrequenzen bis 3 kHz erzeugt diese Kraft eine gegenphasige Bewegung zwischen Lamina reticularis der IHZ und der Unterseite der darüber liegenden Tektorialmembran (Nowotny und Gummer, 2006a; Nowotny und Gummer, 2006b; Nowotny und Gummer, 2011). Diese gegenphasige Bewegung wirkt zusätzlich zur klassischen - in jedem Lehrbuch beschriebenen - Scherbewegung zwischen Lamina reticularis und Tektorialmembran. Der Frequenzbereich, in dem dieser Mechanismus gefunden wurde, ist relevant für Sprache.
Obwohl es eine große Anzahl von audiometrischen Tests zur Differentialdiagnose von Hörstörungen gibt, ist es immer noch nicht möglich, die Position des potentiellen mechanischen Verlustes in der menschlichen Cochlea zu bestimmen. Dies resultiert aus der Tatsache, dass das Innenohr im Felsenbein eingebettet ist und daher nicht für die klinische Untersuchung direkt zugänglich ist. Klinisch ist der einzige Indikator für Hörschäden aufgrund einer Schädigung des cochleären Verstärkers der Verlust von otoakustischen Emissionen. Diese erlauben jedoch keine Differentialdiagnose des cochleären Verstärkers: z.B. um zu entscheiden, ob die Fehlfunktion im Zusammenhang mit einer Entkopplung der Stereozilien der äußeren Haarzellen von der darüber liegenden Tektorialmembran entsteht oder mit einer Störung des Motorkomplexes in der basolateralen Wand der äußeren Haarzelle, . . . usw.
Als Ausgangspunkt für die Entwicklung einer Differenzialdiagnose des cochleären Verstärkers haben wir eine laser-interferometrische Technik entwickelt, um die mechanische Funktion der Cochlea nicht-invasiv anhand von Vibrationsmessungen am Trommelfell zu beurteilen. Dieses Gerät haben wir Laseraudiometer genannt. Um Vibrationsmessungen in der Nähe der Hörschwelle zu ermöglichen, haben wir das Messsystem umkonstruiert, das wir zu einem früheren Zeitpunkt basierend auf einem kommerziell verfügbaren Laserinterferometer entwickelt hatten (Rodriguez Jorge et al., 1997). Mit unserem spezialangefertigten Gerät konnten wir zeigen, dass otoakustische Emissionen gemessen als Vibration des Trommelfells (am Umbo) genutzt werden können um: 1) eine genaue Schätzung der Hörschwelle zu ermitteln (Dalhoff et al., 2007; Turcanu et al., 2007; Turcanu et al., 2009; Dalhoff et al., 2010) und 2) die mechanischen Parameter des Mittelohres zu schätzen (Dalhoff et al., 2011).
Wir führen Untersuchungen mit der unschätzbaren Mitwirkung von normalhörenden Probanden und Patienten mit sensorineuralem Hörverlust fort.
Äußere Haarzellen (ÄHZ) besitzen, wie viele andere polare Zelltypen auch, ein weit verzweigtes endoplasmatisches Netzwerk aus Tubuli und Vesikeln. Im allgemeinen unterstützt ein solches Netzwerk verschiedene, spezialisierte Funktionen, z.B. Proteinsynthese, Kalziumspeicherung, Produktion von Steroiden, Speicherung und Produktion von Glykogen und die Einlagerung von Membranproteinen. Dieses Netzwerk scheint in ÄHZ ausgeprägter zu sein, als in vielen anderen Zelltypen. Die lateralen Zisternen sind als wesentlicher Bestandteil des endoplasmatischen Netzwerks der ÄHZ am Membran-Turnover beteiligt. Haarzellen weisen endozytotische Aktivität sowohl an ihrem apikalen (Endozytose) als auch an ihrem synaptischen (Exozytose) Ende auf. Die Mechanismen des Membran-Recycling, insbesondere der Endozytose, sind bei ÄHZ bis heute nicht ganz verstanden.
Wir untersuchen Membran-Turnover-Prozesse. Um den Vesikel-Transport in ÄHZ zu untersuchen, werden Teile der Zelle mit verschiedenen fluoreszierenden Farbstoffen markiert. Der Farbstoff FM 1-43 markiert die Membran, DiOC6 das endoplasmatische Retikulum und Neutral-Rot die Lysosomen. Die Fluoreszenz dieser Stoffe wird mit einem Zwei-Photonen Laser-Scanning Konfokalmikroskop detektiert. FM 1-43 markiert die Membran reversibel; Vesikel können so nach Endozytose erkannt und ihr Transport in der Zelle beobachtet werden. Es wurde festgestellt, dass die endozytierte Plasmamembran zur infrakutikulären Zone, zu den Subsurface-Cisternae und in die synaptische Region transportiert wird (Meyer et al., 2001; Kaneko et al., 2006). Wir haben gezeigt, dass schnelle Endozytose ein kalzium/kalmodulin-abhängiger Prozess ist, bei dem extrazelluläre Kalziumionen durch spannungsgesteuerte Kalziumkanäle im subnuklearen Bereich der Zelle einfließen (Kaneko et al., 2006). Die zwei verschiedenen Zielorte von endozytierter Membran stimmen mit der funktionellen Unterteilung der ÄHZ überein: einerseits die basolaterale Wand für die elektromechanische Transduktion und andererseits das subnukleare Ende für elektrochemische Prozesse. Unser aktuelles Ziel ist es, die Regulation des intrazellulären Transports der markierten Vesikel in ÄHZ aufzuklären.
Zwei-Photonen
Laser-Scanning Konfokalmikroskop
Messung der
mechanischen Impedanz
Schwingung des
Corti'schen Organs

Abschätzung von Mittelohr-Parametern mittels otoakustischer Emissionen am Umbo